前述研究優化了使用6孔板、6孔板3D固定床模型和CEL-G® Culture Ad60固定床反應器(Ad60 FBR)瞬時轉染含綠色熒光蛋白copGFP的LVs包裝質粒TT-CP1的工藝策略,并確認了TT-CP1質粒在AD60 FBR中能夠成功產出表達。
前述研究文章:案例應用丨慢病毒生產界的“光速引擎”!CEL-G® Culture Ad60 固定床反應器讓轉染效率飛起來!
本文接下來將介紹AD60 FBR在慢病毒生產過程又一典型的應用案例,該研究對慢病毒生產過程中質粒轉染條件和細胞培養參數進行了工藝測試及優化,并使用優化后的工藝條件在表面積為2m2的AD60 FBR驗證測試收獲了高達2.4×1010 TU產量的慢病毒。研究結果為建立基于AD60 FBR的慢病毒載體高效生產工藝提供了強有力的數據支撐。
該研究結果來自于華東理工大學生物反應器工程國家重點實驗室,研究過程中使用的PET膜材及AD60 FBR系上海同騰生物科技有限公司自主研發。文末可查看原文,以下為主要研究結果。
固定床反應器制備
慢病毒載體的需求及應用
基因治療能將外源遺傳物質轉移到患者細胞中,通過抑制或增強基因表達、修正靶基因,從而實現疾病的治療。而在諸多外源基因的轉移方法中,慢病毒載體具有巨大的應用潛力。慢病毒屬于逆轉錄病毒科中的復雜逆轉錄病毒,大多由人類免疫缺陷病毒-1 (Human Immunodeficiency Virus Type 1, HIV-1) 改造而來,能夠同時轉導分裂及非分裂期細胞,具有將外源基因穩定整合至宿主細胞基因組的能力。目前慢病毒載體的應用市場廣闊且前景可觀,預計2026年慢病毒市場將增長至8億美元。
慢病毒的生產主要使用貼壁生長的HEK293T細胞,為實現慢病毒的生產,需要對HEK293T細胞進行規模化培養。目前較多使用的細胞工廠制備工藝路線生產LVs具有多重限制,其中包括且不限于收獲時間限定較緊、人工勞動強度大、系統操作多為開放式并且需要大量的培養箱空間,這些限制為后續商業化規模的病毒制備帶來了壓力,為了克服當前工藝的局限性,固定床生物反應器這種擴展性高的三維貼壁培養體系正在逐漸應用流行,其中商業化較為成熟的固定床反應器包括 Pall 公司的iCELLis 和 Univercells 公司的 Scale-X 以及國產品牌上海同騰生物的AD60 FBR。
AD60 FBR反應罐體內填充有固定化細胞的固相載體PET膜材料(Fig.1),可以為細胞貼附生長提供適宜的介質類型、氣體控制、溫度控制及pH控制等多重精細化支持。當細胞被攪拌驅動攔截在雙層螺旋纏繞的PET膜材空隙中時,培養液流經后與細胞進行傳質傳氧,這種培養方式極大的避免了攪拌引發的剪切力及碰撞造成的細胞損傷等。相對于細胞工廠而言,固定床反應器有著明顯的培養面積優勢,AD60 FBR培養面積設計為1 m2/2 m2、20 m2以及60 m2,對應的細胞工廠層數(細胞工廠每層培養表面積0.063m2)分別是16/32層、320層以及950層,放大規模的AD600 FBR培養面積則高達300 m2/600 m2,對應的細胞工廠層數更是達到了4800層/9600層。另外細胞在AD60 FBR培養過程中的分布十分均勻,能對后續批次重復及放大提供穩定性與重復性支持,從而能加快產品上市速度。

Figure 1 AD60 FBR反應器及載體膜材示意圖
慢病毒生產工藝的
測試及優化參數選擇
在使用固定床反應器生產慢病毒的過程中,轉染條件(如轉染時DNA的濃度、轉染試劑與DNA的比例)以及細胞培養操作參數 (如接種密度、轉染時的細胞密度等)均能夠影響慢病毒的生產。為了實現高效的慢病毒生產,需要探究轉染條件對轉染效率的影響和操作參數對慢病毒滴度的影響,據此設計并開發慢病毒生產工藝。
研究結果
本研究首先考察了轉染試劑聚乙烯亞胺 (Polyethyleneimine, PEI)與DNA 的混合比例、混合時的 DNA濃度和混合時間、轉染時DNA的濃度和轉染時間對轉染效率及外源基因表達的影響。實驗轉染條件分別設置為:PEI與DNA的質量比為0.5:1, 1:1, 2:1, 4:1,6:1,PEI與DNA混合時轉染復合物中DNA的濃度為5, 10, 20, 40, 60μg/mL,混合時間為 0, 5, 10, 20, 30, 60 min,轉染時的DNA濃度為1, 2, 3, 4 μ g/mL,轉染持續時間為2, 4, 6, 8, 10, 12 h。
當PEI與DNA質量比為 2:1,轉染時DNA濃度為2 μ g/mL,轉染時間為6 h時,轉染效率即可達到最高,繼續增加此3個轉染條件的設置值,轉染效率不再提高(Fig.2,a、d、e)。而轉染復合物中 DNA 濃度和混合時間對轉染效率無顯著影響(Fig.2,b、c)。
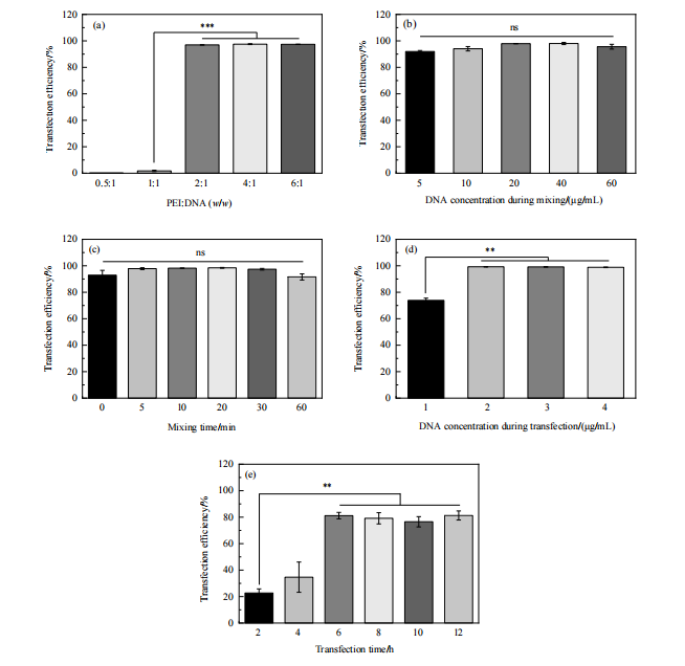
Figure 2 轉染條件對轉染效率的影響:(a) PEI:DNA;(b) 轉染復合物中DNA濃度;(c) 混合時間;(d) 轉染時DNA濃度;(e) 轉染時間 (**: p<0.01; ***: p<0.001)
當PEI與DNA的比例為2:1時相對熒光強度最大,隨上述比例繼續增大,相對熒光強度出現了小幅下降(Fig.3, a)、轉染時的DNA濃度增大和轉染時間延長均有利于外源基因表達(Fig.3, d、e),但較高的DNA濃度將增加生產成本,且在無血清培養條件下長時間轉染可能導致細胞活性降低。因此選擇2μg/mL的DNA濃度和6 h 的轉染時間。轉染復合物中DNA濃度和混合時間對基因表達量的影響較小,二者分別為 20μg/mL 和10 min時基因表達量最高(Fig.3, b、c)。
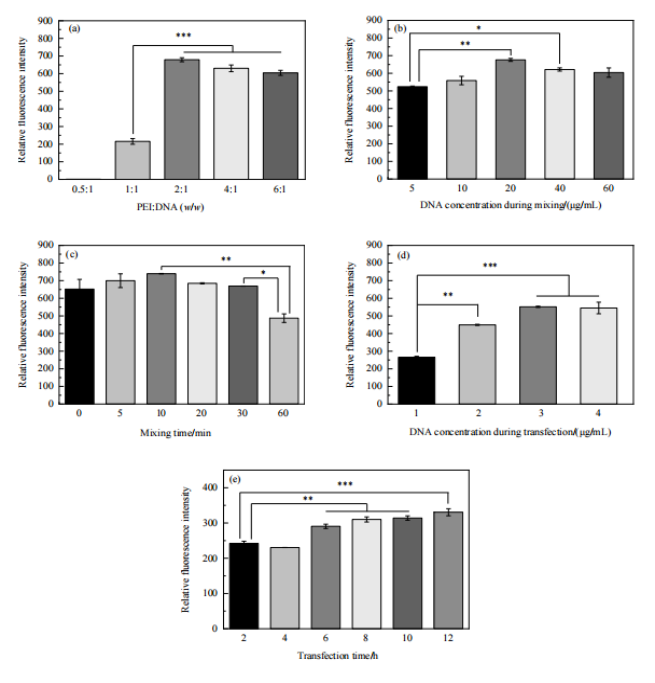
Figure 3 轉染條件對基因表達的影響:(a) PEI:DNA;(b) 轉染復合物中DNA濃度;(c) 混合時間;(d) 轉染時DNA濃度;(e) 轉染時間 (*: p<0.05; **: p<0.01; ***: p<0.001)
基于優化后的轉染條件,在孔板和載有PET膜材的孔板(即孔板3D固定床模型)中進行慢病毒生產。在孔板中進行細胞培養時,生產的慢病毒滴度較高,可達2.9×107 TU/mL,表明在優化的轉染條件下可以生產高滴度的慢病毒。與孔板組相比,孔板3D固定床模型組的慢病毒滴度較低(Fig.4)。考慮到PET膜材具有較高的比表面積,與孔板相比可以支持更多的細胞貼附和生長,因此需優化轉染時的細胞密度等參數,以提高收獲的慢病毒滴度。
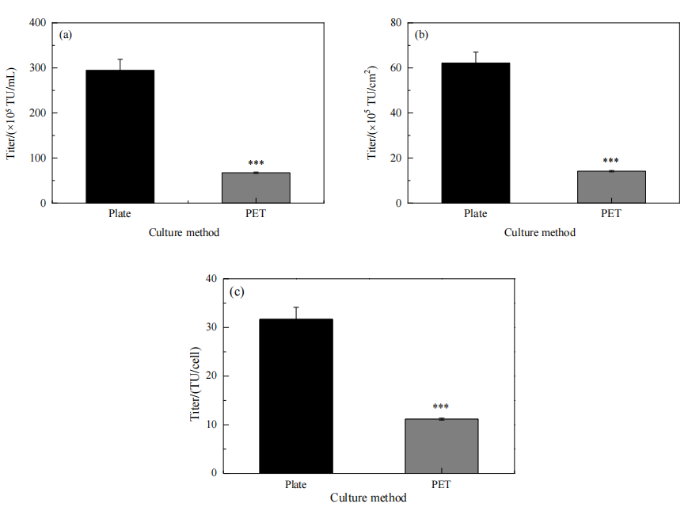
Figure 4 孔板及孔板3D固定床模型生產的慢病毒滴度
隨后將PET膜材置于搖瓶中,采用動態培養模型模擬固定床反應器中的培養過程(即搖瓶3D固定床模型),探究接種密度對細胞生長的影響。將 HEK293T 細胞按 2.0×103, 5.0×103, 1.0×104, 5.0×104cells/cm2的密度分別接種至搖瓶中并進行培養。在5.0×104cells/cm2的接種密度下,搖瓶中HEK293T細胞生長良好,細胞在第6天進入指數生長期,第12天時細胞密度最高,達到2.8×106cells/cm2。此后細胞生長進入穩定期(Fig.5)。
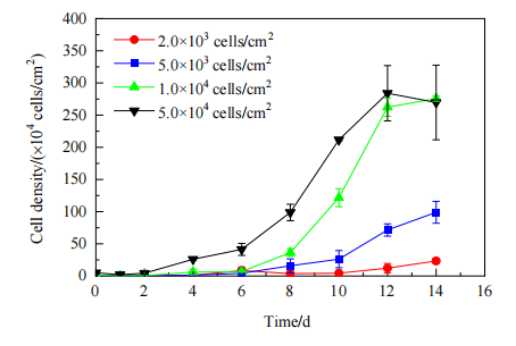
Figure 5 不同接種密度下的HEK293T細胞生長曲線
對不同接種密度下第6, 10和14天的細胞進行活死染色,活細胞被染成綠色,死細胞被染成紅色。在較高的接種密度 (1.0×104和5.0×104cells/cm2)下,HEK293T細胞在搖瓶3D固定床模型上的分布較為均勻。培養至第10天時,5.0×104cells/cm2組的細胞已長滿整個膜材,活性良好。而接種密度降低,膜材上的細胞呈團簇聚集,不均勻的細胞分布和過低的細胞密度不利于質粒轉染和病毒生產。因此后續實驗將采用5.0×104cells/cm2的接種密度(Fig.6)。
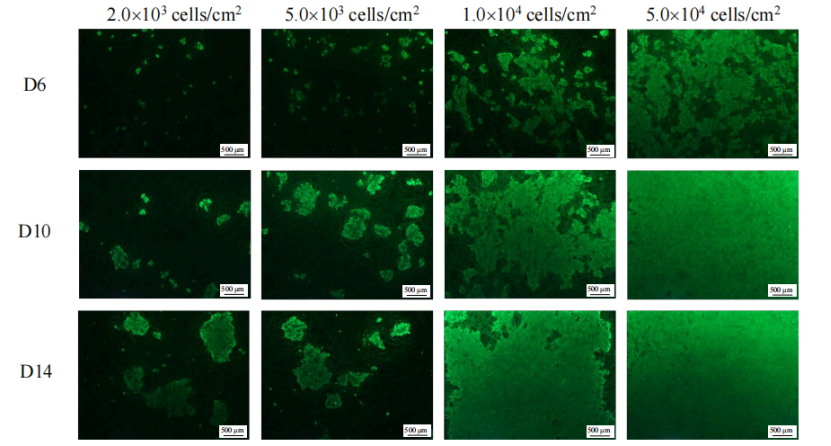
Figure 6 不同接種密度下的HEK293T細胞活性和分布
隨后在搖瓶3D固定床模型細胞密度分別為2.0×105,5.0×105,1.0×106, 2.0×106 cells/cm2時進行轉染,考察轉染密度對慢病毒生產的影響。轉染時細胞密度為 2.0×105和5.0×105cells/cm2時,單細胞產毒量相近,約為0.5 TU/cell。當細胞密度升至 1.0×106cells/cm2時,單細胞產毒量提高至0.8 TU/cell;與其他各組相比,單位體積、單位載體面積、單位細胞的病毒產量均最高。當細胞密度進一步提升時,單細胞產毒量反而下降(Fig.7)。

Figure 7 轉染時的細胞密度對慢病毒滴度的影響:(a) TU/mL;(b) TU/cm2 ;(c) TU/cell (與“10”對比; ***: p<0.001)
最后在AD60 FBR中應用優化后的轉染條件和細胞培養參數進行慢病毒制備,在反應器中以5.0×104 cells/cm2的密度接種細胞,培養期間每天取樣,檢測細胞生長;當細胞密度達到1.0×106 cells/cm2時進行轉染,轉染6 h后更換含血清培養基。慢病毒生產期間每天檢測培養上清液中葡萄糖濃度。分析AD60 FBR中HEK293T細胞的生長數據(Fig.8),培養第1天時細胞密度為5.7×104 cells/cm2,大于接種密度,表明細胞貼附后開始擴增。在第3天細胞生長進入指數生長期,第5天細胞密度增加至1.0×106 cells/cm2。與搖瓶的培養結果相比,固定床反應器中細胞更快進入指數生長期。
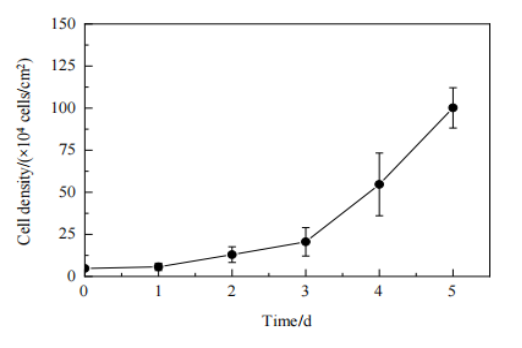
Figure 8 固定床反應器中的細胞生長曲線
對AD60 FBR中生長階段的細胞活性和分布情況進行了檢測(Fig.9)。由圖可知,反應器載體填充材料PET膜材是由無序堆積的纖維形成的三維細胞培養載體;除部分纖維較稀疏的區域,細胞經過5天生長后可較均勻地鋪滿材料,細胞活性良好,未見可觀察到的死細胞。表明該接種密度和轉染時的細胞密度較為合適,在充分利用PET床面積的同時未導致細胞過度重疊、聚團。
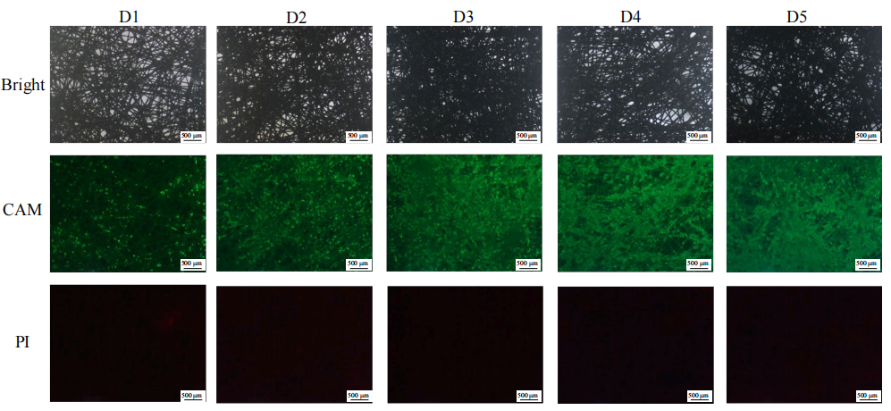
Figure 9 固定床反應器中的細胞分布
對AD60 FBR反應器中生產出的慢病毒進行了滴度檢測,在質粒DNA轉染后的第3天(即培養第8天),慢病毒滴度顯著增加,此時上清液中的病毒滴度可達1.3×107 TU/mL、8.5×106 TU/cm2,單細胞產毒量為 8.5 TU/cell;與之相比,培養第 7 天時,上清液中病毒滴度為 2.5×106 TU/mL、1.7×106 TU/cm2,單細胞產毒量為1.7 TU/cell。培養第7天收獲1 L培養上清液,培養第8天收獲1.7 L培養上清液,合計收獲總病毒量為2.4×1010 TU,平均病毒滴度為8.9×106 TU/mL、9.6×106 TU/cm2 (以2 m2等效面積計算為 1.2×106TU/cm2)和9.6 TU/cell。上述數據證實AD60 FBR生產出的慢病毒滴度較高,表明所優化的轉染條件和生產條件支持固定床反應器中慢病毒的高效生產。
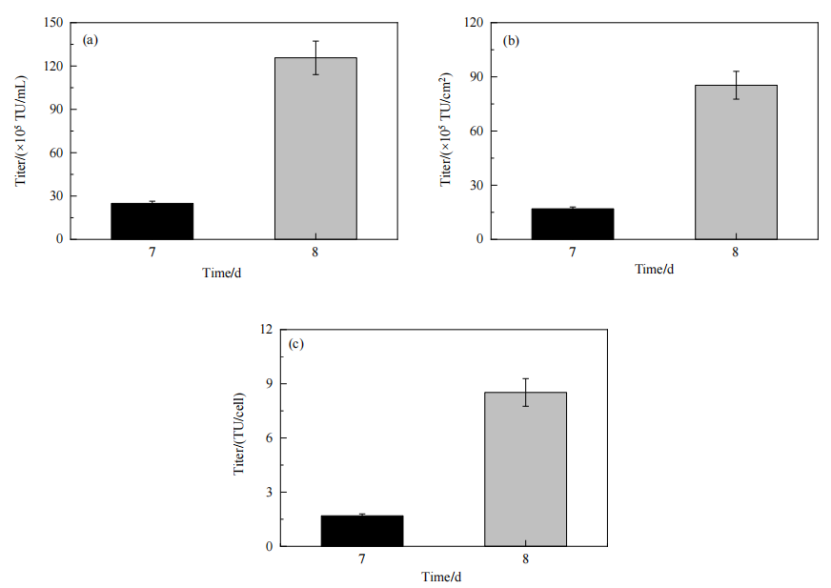
Figure 10 固定床反應器中生產的慢病毒滴度:(a) TU/mL;(b) TU/cm2 ;(c) TU/cell
以CEL-G® Culture Ad60為代表的固定床生物反應器作為細胞大規模貼壁培養的設備,在慢病毒制備領域證實具有巨大的潛力。華東理工大學的研究通過優化質粒轉染條件和細胞培養參數,實現了固定床反應器中的高滴度慢病毒生產。相信未來通過工藝進一步優化,AD60 FBR可以為LVs乃至更多病毒載體的大規模制備提供解決方案。并且,隨著研究的不斷深入,以固定床反應器為基礎開發可擴展、經濟高效且臨床可接受的病毒生產工藝將會成為實現基因和細胞療法變革的基石。




